穀(gǔ)物中(zhōng)含(hán)有多種金屬離子,大(dà)部分對於身體健康有重要(yào)作用,其含量(liàng)範(fàn)圍集中在10-100 µg/g,屬(shǔ)於微量分析。對於金屬的處理,大部分的(de)現有文獻采取的是以混合強酸加熱並溶解的方法,但是這種方法本身極具危險性,而且環境(jìng)有極大的(de)影(yǐng)響。所以本次實驗中(zhōng)選擇進行(háng)長時間的灰化以除去有機物,代替酸解的方法。
對於金屬的微量分析,分光光度法靈敏度高,易於操作,是當前十分經典的測量微量金屬的方法。但分光光(guāng)度法存在著準確度極差的缺點,所以我們希望找到可以全部替代或部分替代分(fèn)光光度的方(fāng)法。滴定法時常用的準確分析的方法,誤差(chà)極小,EDTA是(shì)一種極強的(de)絡合劑,可以和多種金屬(shǔ)離子絡合,常用(yòng)來測(cè)量金屬離子的含量。因此,本實驗將這(zhè)兩種方法結合,采用
實驗電熱板消解加熱測量穀物中的金屬含量。

實驗過程
儀器與試劑
實驗電熱板HT-200(格丹(dān)納)
紫外可見分光光度計
基準碳酸鈣,鐵標準溶液,基準氧化鋅,六水合氯化鎂,1%鈣指示劑(jì),鋅試劑(jì)固體,0.20%鄰二氨菲溶液,pH-8.8的硼砂(shā)硼(péng)酸緩衝溶液
實驗方法
1.樣品處理
稱取20.0g樣品於坩堝中,先在實驗電熱板上預加熱蒸發至(zhì)無水分,固體呈黑色,轉移至馬弗爐,加入適量濃硝酸,灼燒至固體(tǐ)呈灰白色。用5%硝酸溶解殘留固體並(bìng)定容至100mL。
2.標準溶液配製。
3.鈣鎂含量測定
1)鈣鎂總量測定
利用EDTA與鈣鎂絡合的反(fǎn)應,在溶液(yè)中加入三乙醇胺掩蔽(bì)鐵離子的幹擾,再加(jiā)入(rù)適(shì)量氨性緩衝溶液,以EBT為指示劑滴定(dìng)溶液中的鈣鎂(měi)總量。
2)鈣含量測(cè)定
在溶液(yè)中加入氫(qīng)氧化鈉溶(róng)液調節pH 至11-12,以鈣指示劑為指示劑,用EDTA標準溶液(yè)滴定(dìng)鈣離子含量。
4.鋅含(hán)量測定
在溶(róng)液中加入三乙醇胺掩蔽鐵離子,加(jiā)入4mL鋅試劑,再加(jiā)入 3mL硼砂硼酸緩衝溶液調節pH 至8.8,用蒸(zhēng)餾水稀釋至25.0mL,用分光光度計在618nm 處測定吸光度。
5.鐵含量測定
在溶液中加入1.0mL鹽酸羥胺(àn),混勻靜置2min後加入1.0mL鄰二氮菲溶液和2.0mL乙酸鈉,加水稀釋至25.0mL,在510nm測定吸(xī)光度。
結果與討論

實際樣品中(zhōng)離子濃度(dù)的測定
樣品經(jīng)過(guò)長時間灰化後仍有少量紫色物質(zhì)存在(zài),可能是其他離子或殘餘有(yǒu)機物。灰化後,大米樣品殘餘量極低,可能是誤差增大的原(yuán)因之一。
最終ICP測試數據顯示:
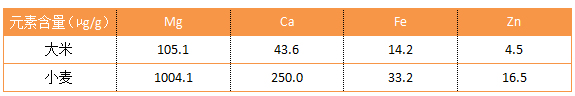
與所測得的數據相差較大,推測原因(yīn)是(shì)對於實際(jì)樣品中的離子環境估計不足,仍存在很(hěn)多未知離子的幹擾,需要進一步的研究。
總結
實驗最終探索出了一條基本可以確定穀(gǔ)物(wù)重金屬含量的方案,但誤差較大,仍存在許多地方(fāng)可以改進。由於時間原因,並未進行更深(shēn)入的探索及研究。最(zuì)終的樣品體係中存在許多雜離子,所采取(qǔ)的實驗方(fāng)案並不(bú)能全(quán)部(bù)消除影響。本次實驗(yàn)中的格丹納實驗電熱板HT-200采用了陶瓷板加熱體發熱提供高(gāo)溫熱量讓樣品加熱,使樣品受熱麵積更加的均勻。並且是分體控製方式,在通風櫥外進行控製加熱,科研人員可以遠離酸霧和熱量,安全又方便。
 020-87026501
020-87026501






 全國服務熱(rè)線
全國服務熱(rè)線 掃一掃 微(wēi)信二維碼
掃一掃 微(wēi)信二維碼